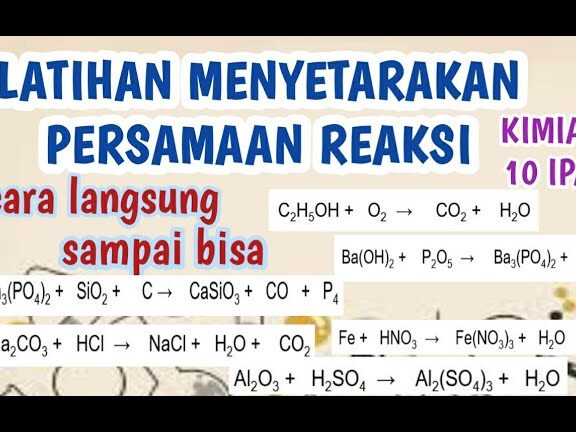
Memahami soal penyetaraan reaksi kimia adalah langkah penting bagi kita yang ingin menguasai ilmu kimia. Dalam proses ini, kita akan belajar bagaimana menyeimbangkan reaksi kimia dengan benar dan efisien. Menyetarakan reaksi tidak hanya penting dalam ujian tetapi juga dalam aplikasi dunia nyata seperti industri dan penelitian.
Di artikel ini kami akan membahas berbagai jenis soal penyetaraan reaksi serta teknik penyelesaiannya. Kami juga akan memberikan contoh-contoh praktis yang dapat membantu memperdalam pemahaman kita tentang topik ini. Apakah Anda pernah merasa bingung saat menghadapi soal-soal tersebut? Jangan khawatir karena kami di sini untuk menjelaskan setiap langkah secara rinci agar Anda bisa lebih percaya diri dalam menyelesaikan soal penyetaraan reaksi. Mari kita mulai perjalanan ini bersama-sama!
Soal Penyetaraan Reaksi Kimia Dasar
Pada bagian ini, kita akan membahas soal penyetaraan reaksi kimia dasar yang sering muncul dalam pengajaran dan ujian. Penyetaraan reaksi kimia adalah proses penting untuk memastikan bahwa jumlah atom dari setiap unsur di sisi reaktan sama dengan jumlah atom di sisi produk. Dengan memahami cara menyetarakan reaksi, kita dapat menghindari kesalahan dalam perhitungan stoikiometri dan memahami lebih baik interaksi antara zat-zat kimia.
Langkah-Langkah Penyelesaian Soal
Untuk menyelesaikan soal penyetaraan reaksi, kita perlu mengikuti beberapa langkah sistematis:
- Tuliskan Reaksi Awal: Mulailah dengan menuliskan rumus kimia dari semua bahan yang terlibat.
- Identifikasi Jumlah Atom: Hitung jumlah atom untuk setiap unsur pada kedua sisi (reaktan dan produk).
- Tentukan Koefisien Stoikiometri: Sesuaikan koefisien di depan rumus untuk menyeimbangkan jumlah atom dari masing-masing unsur.
- Periksa Keseimbangan: Pastikan bahwa total jumlah atom di kedua sisi sudah seimbang.
Dengan mengikuti langkah-langkah ini, kita dapat menangani berbagai jenis soal penyetaraan reaksi kimia dengan lebih mudah.
Contoh Soal Dasar
Mari kita lihat contoh berikut sebagai ilustrasi:
Reaksi:
[ text{C} + text{O}_2 rightarrow text{CO}_2 ]
Dari reaksi tersebut, ketika dihitung:
- Di sebelah kiri, terdapat 1 atom karbon (C) dan 2 atom oksigen (O).
- Di sebelah kanan, ada 1 atom karbon (C) dan juga 2 atom oksigen (O).
Karena jumlahnya sudah seimbang, maka reaksi ini telah disetarakan dengan benar.
Berikut adalah tabel yang menunjukkan komposisi awal dan akhir dari contoh tersebut:
| Unsur | Sisi Reaktan | Sisi Produk |
|---|---|---|
| Karbon (C) | 1 | 1 |
| Oksigen (O) | 2 | 2 |
Kesimpulan Sementara
Memahami dasar-dasar penyetaraan reaksi sangat membantu dalam menjawab berbagai tipe soal yang berkaitan dengan stoikiometri dan perubahan energi dalam suatu sistem kimia. Melalui latihan rutin dan penerapan langkah-langkah di atas, kemampuan kita dalam menyelesaikan soal-soal terkait akan semakin meningkat secara signifikan.
Metode Penyelesaian Soal Penyetaraan Reaksi
Untuk menyelesaikan soal penyetaraan reaksi, kita perlu memahami beberapa metode yang dapat membantu kita dalam proses ini. Dengan menggunakan pendekatan yang sistematis, kita tidak hanya akan lebih mudah dalam menemukan solusi, tetapi juga akan memperkuat pemahaman kita tentang konsep dasar kimia.
Metode Penyetaraan Reaksi
Ada beberapa metode yang umum digunakan untuk menyetarakan reaksi kimia, antara lain:
- Metode Koefisien: Dalam metode ini, kita menyesuaikan koefisien di depan rumus kimia agar jumlah atom dari setiap unsur sama pada kedua sisi reaksi. Ini adalah cara paling umum dan sering digunakan karena memberikan hasil yang jelas dan mudah dipahami.
- Metode Setengah Reaksi: Digunakan terutama dalam reaksi redoks (reduksi-oksidasi), di mana kita memecah reaksi menjadi dua setengah reaksi-satu untuk oksidasi dan satu untuk reduksi. Setelah masing-masing disetarakan, kedua setengah reaksi digabungkan kembali untuk mendapatkan keseluruhan reaksi seimbang.
- Metode Ion Elektron: Mirip dengan metode setengah reaksi, namun lebih berfokus pada perubahan muatan listrik selama proses pengionan. Ini berguna saat menangani larutan elektrolit atau sistem ionik lainnya.
- Metode Algebraik: Metode ini melibatkan penulisan persamaan matematis berdasarkan jumlah atom dari setiap unsur di kedua sisi reaktan dan produk. Kita kemudian menyelesaikan persamaan tersebut secara aljabar untuk mendapatkan nilai koefisien yang tepat.
Dengan mengetahui berbagai metode ini, kami bisa memilih teknik yang paling sesuai dengan jenis soal penyetaraan yang dihadapi. Selain itu, latihan rutin menggunakan berbagai pendekatan akan meningkatkan kemampuan kami dalam mengatasi masalah-masalah terkait penyetaraan reaksi kimia.
Perbandingan Metode
Berikut adalah tabel perbandingan singkat dari setiap metode:
| Metode | Kelebihan | Kekurangan |
|---|---|---|
| Koefisien | Mudah dipahami; cepat. | Terkadang membutuhkan percobaan berulang. |
| Setengah Reaksi | Bermanfaat untuk redoks; detail jelas. | Panjang; bisa membingungkan bagi pemula. |
| Ion Elektron | Akurasi tinggi dalam larutan ionik. | Khusus; tidak selalu diperlukan. |
| Algebraik | Sangat akurat; cocok untuk semua tipe soal. | Pembelajaran lebih kompleks; waktu lama. |
Memilih metode yang tepat sangat penting agar proses penyetaraan berlangsung efektif dan efisien. Kami harus mencoba berbagai pendekatan agar mampu menyesuaikan dengan kebutuhan spesifik dari soal-soal penyetaraan reaksi kimia yang ada.
Contoh Soal dan Pembahasan Penyetaraan Reaksi
Pada bagian ini, kami akan memberikan beberapa contoh soal penyetaraan reaksi serta pembahasannya. Contoh-contoh ini dirancang untuk membantu kita menerapkan metode yang telah dibahas sebelumnya dan meningkatkan pemahaman kita dalam menyetarakan reaksi kimia.
Contoh Soal 1
Reaksi antara natrium (Na) dan klor (Cl₂) menghasilkan natrium klorida (NaCl). Tulis persamaan reaksi tersebut dan setarakan!
Pembahasan:
- Menulis persamaan awal:
[
text{Na} + text{Cl}_2 rightarrow text{NaCl}
]
- Menghitung jumlah atom di sisi kiri:
- Na: 1
- Cl: 2
- Menghitung jumlah atom di sisi kanan:
- Na: 1
- Cl: 1
- Untuk menyetarakan Cl, kita perlu menambahkan koefisien pada NaCl:
[
text{Na} + text{Cl}_2 rightarrow 2text{NaCl}
]
- Sekarang, kita harus menyesuaikan jumlah natrium dengan menambahkan koefisien di depan Na:
[
2text{Na} + text{Cl}_2 rightarrow 2text{NaCl}
]
- Reaksi kini sudah seimbang dengan dua atom Natrium dan dua atom Klorin.
Contoh Soal 2
Senyawa sulfur dioksida (SO₂) bereaksi dengan oksigen (O₂) membentuk sulfur trioksida (SO₃). Setarakan reaksi berikut:
Pembahasan:
- Menulis persamaan awal:
[
text{SO}_2 + O_2 → SO_3
]
- Menghitung jumlah atom di sisi kiri:
- S: 1
- O: 4
- Menghitung jumlah atom di sisi kanan:
- S: 1
- O: 3
- Kita dapat mengatur koefisien untuk memastikan keseimbangan oksigen.
- Dengan menambahkan koefisien pada SO₃ menjadi dua, maka persamaannya adalah sebagai berikut:
(
{2text{SO}}_2 + O_2 → {4text{SO}}_3
}
{
=
{6 O }
< > >
>
>
^
}
- Setelah menyesuaikan kedua belah pihak, reaksinya menjadi seimbang.
Dengan mempraktikkan contoh-contoh soal penyetaraan reaksi seperti ini, kami semakin memahami pentingnya proses penyetaraan dalam kimia dan bagaimana berbagai metode dapat diterapkan untuk mencapai hasil yang akurat dan efisien dalam soal-soal penyetaraan reaksi yang lebih kompleks ke depannya.
Kesalahan Umum dalam Menyelesaikan Soal Penyetaraan
Dalam menyelesaikan soal penyetaraan reaksi, terdapat beberapa kesalahan umum yang sering dilakukan oleh siswa. Kesalahan ini dapat mengakibatkan hasil yang tidak akurat dan pemahaman yang kurang mendalam tentang konsep reaksi kimia. Oleh karena itu, penting bagi kita untuk mengenali dan menghindari kesalahan-kesalahan tersebut.
Kesalahan 1: Mengabaikan Jumlah Atom
Salah satu kesalahan paling umum adalah mengabaikan jumlah atom di sisi kiri dan kanan persamaan. Siswa sering kali menulis koefisien tanpa memeriksa terlebih dahulu apakah jumlah atom untuk setiap unsur sudah seimbang. Penting untuk selalu menghitung jumlah atom sebelum dan sesudah penyetaraan agar bisa memastikan bahwa reaksi benar-benar seimbang.
Kesalahan 2: Menggunakan Koefisien yang Salah
Kesalahan lain adalah penggunaan koefisien yang tidak tepat saat menyetarakan reaksi. Misalnya, dalam kasus di mana dua molekul dari satu senyawa harus digunakan tetapi hanya satu ditambahkan, hal ini akan menyebabkan ketidakcocokan dalam jumlah atom di kedua sisi persamaan. Selalu pastikan bahwa koefisien yang digunakan mencerminkan proporsi sebenarnya dari zat-zat dalam reaksi.
Kesalahan 3: Tidak Memperhatikan Tipe Reaksi
Tipe reaksi juga sangat penting untuk diperhatikan saat menyelesaikan soal penyetaraan reaksi. Beberapa siswa mungkin tidak memahami perbedaan antara reaksi redoks, asam-basa, atau pengendapan, sehingga mereka tidak dapat menerapkan metode penyetaraan dengan benar sesuai konteksnya. Memahami tipe-tipe ini membantu kita memilih strategi penyetaraan yang tepat.
Dengan mengenali kesalahan-kesalahan tersebut dan berusaha untuk memperbaikinya, kita dapat meningkatkan kemampuan dalam menyelesaikan soal penyetaraan reaksi kimia secara lebih efisien dan akurat. Hal ini tentunya akan berdampak positif terhadap pemahaman kita mengenai konsep dasar kimia serta penerapannya dalam situasi nyata.
Pentingnya Pemahaman Penyetaraan Reaksi dalam Kimia
Pentingnya pemahaman tentang penyetaraan reaksi dalam kimia tidak dapat diremehkan. Ketika kita menghadapi soal penyetaraan reaksi, pemahaman yang mendalam mengenai konsep ini akan sangat membantu kita untuk menyelesaikan masalah dengan tepat dan efisien. Penyetaraan reaksi adalah proses di mana jumlah atom dari setiap unsur di sisi reactan harus sama dengan jumlah atom dari unsur yang sama di sisi produk. Ini bukan hanya sekadar aturan, tetapi juga mencerminkan prinsip kekekalan massa.
Salah satu alasan utama mengapa pemahaman penyetaraan reaksi sangat penting adalah karena ini menjadi dasar bagi banyak konsep kimia lainnya. Misalnya, dalam studi tentang stoikiometri, kita perlu menggunakan persamaan seimbang untuk menghitung proporsi zat yang terlibat dalam suatu reaksi. Tanpa pengetahuan yang baik tentang cara menyetarakan reaksi, siswa mungkin kesulitan ketika mencoba menerapkan perhitungan kuantitatif tersebut.
Manfaat Memahami Penyetaraan Reaksi
Dengan memahami penyetaraan reaksi secara menyeluruh, kita akan mendapatkan beberapa manfaat berikut:
- Meningkatkan Akurasi: Mengetahui cara menyetarakan reaksi memastikan bahwa hasil akhir dari eksperimen atau perhitungan kita akurat.
- Mengembangkan Keterampilan Pemecahan Masalah: Proses penyetaraan sering kali melibatkan strategi berpikir kritis dan analitis.
- Memudahkan Pembelajaran Konsep Lanjutan: Banyak topik lanjutan dalam kimia bergantung pada kemampuan untuk memahami dan menerapkan prinsip-prinsip dasar penyetaraan.
Kesimpulan Praktis
Untuk memaksimalkan pemahaman kita terhadap soal penyetaraan reaksi, disarankan untuk melakukan latihan secara berkala. Menghadapi berbagai jenis soal serta berlatih menyeimbangkan berbagai macam persamaan akan membantu memperkuat keterampilan ini. Dengan demikian, kita tidak hanya siap menghadapi ujian atau tugas akademik tetapi juga lebih mampu menerapkan konsep-konsep tersebut dalam situasi kehidupan nyata seperti industri kimia atau penelitian ilmiah.